Pytanie Ogórka: Zainteresowały mnie ostatnio rozmiary atomów. Zdaję sobie sprawę, że są one bardzo małe, że w ziarenku soli można ich znaleźć miliardy. Zacząłem się jednak zastanawiać, czy wszystkie atomy cechują identyczne lub chociaż zbliżone wymiary? Czy jeżeli przykładowy uran jest wielokrotnie masywniejszy i bardziej złożony od wodoru, ma również znacznie większy promień?
Zacznijmy od uściślenia przedmiotu pytania. Atom jest złożoną strukturą z gęstym jądrem pośrodku, otoczonym przez znacznie mniejsze, ruchliwe elektrony. Aby poznać jego promień musimy zatem wyznaczyć odległość pomiędzy atomowym jądrem a krańcowymi elektronami.
W innych tekstach uczulałeś, że atom i budujące go cząstki w niczym nie przypominają dużych obiektów, ze względu na mechanikę kwantową i takie tam. Tutaj natomiast traktujemy atom jak jakąś kulę z jasno określonym promieniem?
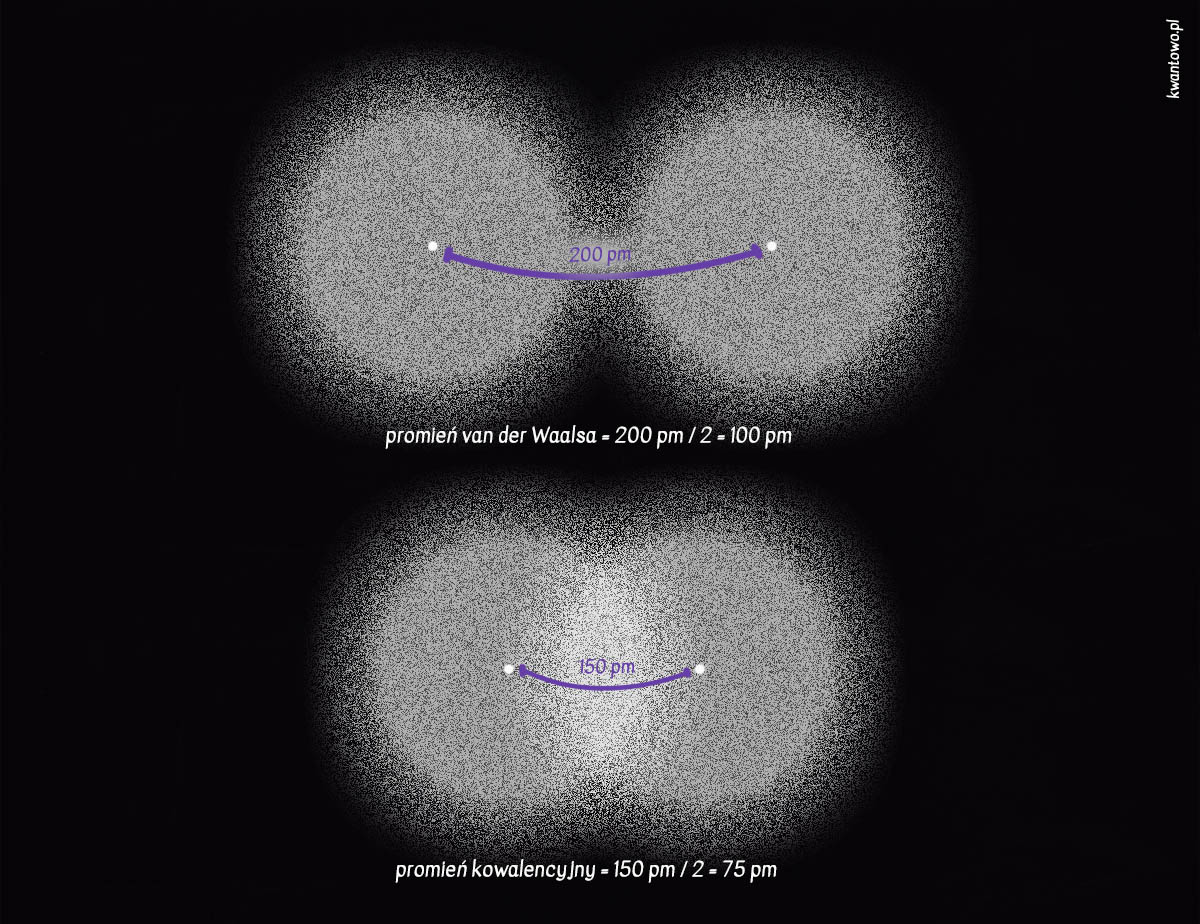
Słuszna uwaga. Chmura elektronowa nie posiada ostrej granicy, zaś prawdopodobieństwo spotkania elektronu spada stopniowo wraz z odległością od jądra. Na szczęście fizycy potrafią być kreatywni. W tej sytuacji wymyślili, że najlepiej wziąć pod lupę substancję z uporządkowanymi, stykającymi się atomami tego samego pierwiastka, następnie zmierzyć odległość pomiędzy dwoma jądrami (technicznie najłatwiejszymi do zlokalizowania) i po prostu podzielić ją na pół[1]. Nie jest to może szczególnie wyrafinowana metoda, ale pozwala skutecznie oszacować promień większości pierwiastków.
To już chyba chemia, a od chemii zaczynam kisnąć. Przejdźmy lepiej do samych wielkości.
W praktyce długość promienia atomowego mieści się zwykle w granicach od kilkudziesięciu do kilkuset pikometrów (10-12 m), czyli bilionowych części metra. Z naszej perspektywy to niewiarygodnie mała liczba, ale warto zauważyć, że już dla cząstek elementarnych taka przestrzeń jest ogromna. Promień samego jądra mierzy zwykle mniej niż 10 femtometrów (10-15 m). Innymi słowy, protony i neutrony kumulujące w sobie 99,9% masy całego atomu, nie stanowią nawet tysięcznej części jego objętości. Zostawmy to jednak na marginesie i wróćmy do postawionego pytania.
Tak, poszczególne atomy różnią się wielkościami. Mało tego, nawet dwa atomy tego samego pierwiastka – bliźniacze pod względem struktury – w pewnych okolicznościach mogą posiadać zupełnie inny promień.
To znaczy, że w dwóch atomach wodoru elektron może obiegać jądro w różnej odległości?
Dokładnie. Wystarczy dostarczyć mu odpowiedniego “kopa”. Kiedy atom wodoru przechodzi w stan wzbudzony, elektron dokonuje skoku (liczę, że jesteś po lekturze ogórkowego tekstu wyjaśniającego czym są kwanty i skoki kwantowe) na wyższy poziom energetyczny. To oznacza, że tymczasowo wielkość atomu znacznie wzrośnie. Rozrzut pomiędzy stanem podstawowym, a kolejnymi stanami wzbudzonymi może być kolosalny (co widać choćby po rozmieszczeniu prążków widma emisyjnego). Przykładowo, jeżeli elektron wskoczy na drugi dostępny szczebel energetyczny, atom wodoru urośnie czterokrotnie; a na trzecim poziomie spuchnie nawet dziewięciokrotnie.
Może i tak, ale atom w końcu zwróci energię, elektron spadnie i wszystko wróci do normy. Bardziej mnie interesuje, co z atomami w stanie podstawowym i różnymi pierwiastkami? Czy atom sto razy masywniejszy od drugiego, będzie również sto razy większy?
Różne pierwiastki mają różne wielkości, ale nie występuje tu wcale prosta zależność między masą a rozmiarem. Promień litu – najlżejszego pierwiastka zaraz po wodorze i helu – mierzy 170 pikometrów. Sporo. Czyni to atom litu znacznie obszerniejszym m.in. od atomu węgla (70 pm), tlenu (50 pm), fluoru (40 pm), a nawet żelaza (160 pm). Ogólnie, najdłuższym promieniem wynoszącym niemal 300 pm, może pochwalić się zupełnie przeciętny pod względem masy cez.
Chcesz mi powiedzieć, że nie ma tu żadnego porządku, żadnej zależności?
Jest, jeśli się dobrze przyjrzeć. O rozmiarach atomów decydują głównie dwa czynniki. Pierwszy to liczba powłok elektronowych otaczających jądro atomowe.
Kisnę…
Może inaczej. Kwantowe reguły[2] bywają bardzo restrykcyjne i decydują o rozmieszczeniu elektronów wokół jądra atomowego. Każdy elektron chciałby zająć fotel w najniższym rzędzie tuż pod sceną, ale liczba miejsc jest ściśle ograniczona, więc przy dużej liczbie gości zapełniane są kolejne, wyższe rzędy. To właśnie nasze powłoki. Nie ma chyba nic dziwnego w tym, że atom dysponujący tylko jedną powłoką, będzie znacznie szczuplejszy od tego z pięcioma lub sześcioma. Przekładając to na układ okresowy (taką kolorową planszę, która na pewno zdobiła jedną ze ścian Twojej pracowni chemicznej), rozmiary pierwiastków rosną zwykle w każdej kolumnie (grupie), z góry na dół. Sód posiada większy promień od litu, potas od sodu, rubid od potasu, a cez od rubidu.

Atomy o większej liczbie powłok są szersze od tych, które mają tych powłok mniej. Dobra, chwytam to.
Drugi czynnik, związany jest z liczbą atomową[3] (oznaczaną literą Z). I tu trafiamy na coś nieintuicyjnego. Jeżeli dwa pierwiastki mają tyle samo powłok elektronowych, zwykle większy promień będzie miał ten zawierający mniej (!) protonów i elektronów. Węgiel (Z=6) jest większy od azotu, azot (Z=7) jest większy od tlenu, a tlen (Z=8) jest większy od fluoru (Z=9). Zerkając znów na układ okresowy, dostrzeżemy, że w poszczególnych rzędach (okresach) pierwiastki maleją od lewej do prawej – w miarę wzrastania ich liczby atomowej.

Czyli różne pierwiastki mogą posiadać np. dwie powłoki elektronowe, a mimo to mieć odmienne rozmiary? To chyba oznacza, że w jednym przypadku powłoki będą szersze, a w innym węższe. Tylko dlaczego?
Dokładnie tak. Wynika to z oddziaływań pomiędzy cząstkami. Jak pewnie wiesz, jądro atomu pozostaje obdarzone dodatnim ładunkiem elektrycznym, dzięki czemu utrzymuje w ryzach ujemnie naładowane elektrony. Cięższe jądro, wyposażone w większą liczbę protonów mocniej przyciąga otaczające je elektrony, kurcząc ich “orbity”. Siły elektrostatyczne pomiędzy sześcioma protonami i sześcioma elektronami w atomie węgla, są po prostu słabsze od wzajemnego oddziaływania dziewięciu protonów i dziewięciu elektronów w atomie fluoru. Efekt jest taki, że zewnętrzna (w tym przypadku druga) powłoka elektronowa fluoru znajduje się o 20 pikometrów bliżej jądra niż w przypadku węgla.
Oczywiście atom to dynamiczny i złożony mechanizm, a na dokładny wynik mają wpływ również wzajemne oddziaływania między samymi elektronami oraz pomniejsze efekty kwantowe. Jednak co do zasady, wielkość atomu waha się się od 50 do 300 pm i nie ma to zbyt wiele wspólnego z jego masą.